¿Cómo funciona la batería de 12 voltios del coche?

Hasta la generalización de los móviles, la batería de 12 voltios del coche ha sido la batería «secundaria» (esto es, recargable) con la que todos hemos tenido más experiencia. De ella sabemos que es cúbica, pesada y que, por lo visto, está repleta de ácido sulfúrico. Y que debe de llevar plomo, porque siempre se refieren a ella con esa etiqueta. Pero… ¿cómo funciona, exactamente, la batería de 12 voltios del coche? Descubrirlo nos va a ayudar, también, a aprender mucho sobre ella, sus parámetros y mantenimiento.

Una de las primeras batería de plomo-ácido de Planché
1) Una batería con historia
Lo primero que debes saber es que la batería de plomo, o de ácido-plomo, es la batería recargable con más historia. La inventó el físico francés Gastón Planté en 1859, y todavía en la actualidad sigue siendo el tipo de batería recargable de la que más unidades se han fabricado. En su día, la batería de Planté era un dispositivo tan sofisticado que ni siquiera existían cargadores para recargarla… aunque la máquina de Gramme, magneto o dinamo se inventaría poco después.
Hay tres excelentes razones por las que la batería de plomo-ácido ha sido un éxito desde su concepción: su bajo coste, su elevada fiabilidad y su facilidad de construcción. Aunque, antes de disfrutarla, fue necesario «pulir algunas esquinas», de cara a alcanzar cifras decentes de prestaciones. Pero, de momento, vamos a analizar cómo es la batería de 12 voltios del coche, desde fuera y hacia dentro.

Hemos sido engañados… dentro de las baterías hay ¡más baterías!
2) Sorpresa: no existen las baterías de 12 voltios
Cuando uno escucha hablar de baterías de 12 voltios, o de 9 voltios, o de 4,5 voltios, y ve sus carcasas… espera que dentro haya, literalmente, UNA batería de esa tensión. Por desgracia, eso es imposible. Cada reacción química de tipo Red-Ox (así se denomina a aquellas que tienen lugar con intercambio de electrones, que son las que nos interesan de cara a construir una batería) tiene una tensión asociada. Y es imposible pasar de unos 4 voltios. De manera que no podemos hacer «una batería de 12 voltios»… salvo si conectamos, a escondidas y en serie, varias baterias de tensión inferior para dar lo que se conoce como «paquete de baterías».
Por eso, y en realidad, una batería de 12 voltios es un paquete de seis baterías (en adelante, y para distinguirlas de la propia batería, las llamaremos celdas) de plomo-acido, conectadas en serie, y con cada una de ellas entregando 2,1 voltios de tensión. En el pasado, antes de que las baterías fueran herméticas (esto es, «sin mantenimiento»), cada una de estas seis celdas se la denominaba «vaso», y contaba con un tapón para poder reponer su nivel de agua. Siguiendo la misma lógica, cuando la batería fallaba porque una de las celdas se deterioraba, la tensión caía de 12 a 10 voltios, y se decía que experimentaba un «vaso comunicado»; esto es, un cortocircuito en una celda.

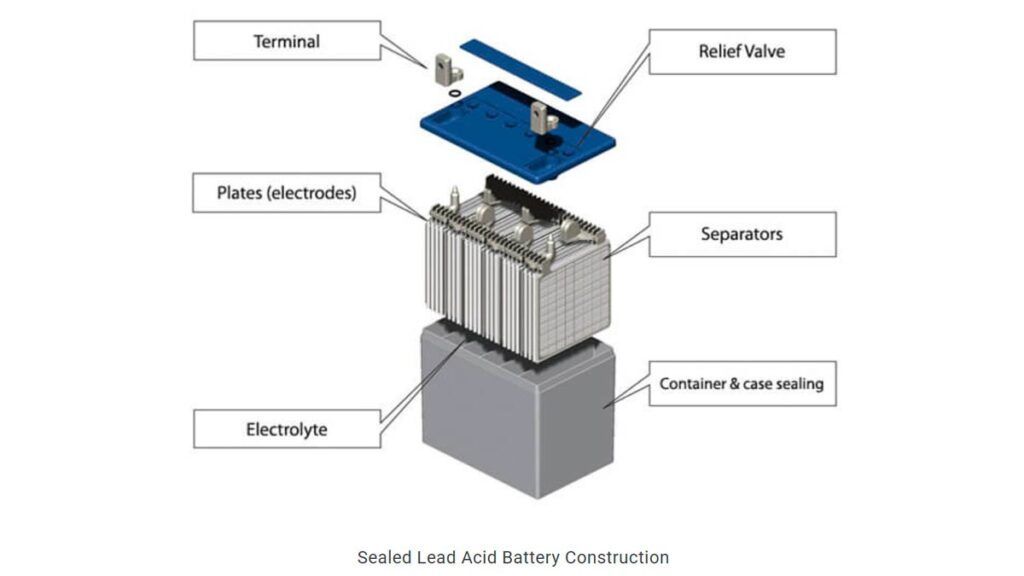
3) Anatomía típica de una batería de 12 voltios
El interior de una batería de 12 voltios siempre tiene el mismo aspecto. Cuenta con los siguientes componentes:
- Terminales: Uno para el positivo (cable rojo) y otro para el negativo (cable negro).
- Carcasa: De plástico, dividida en seis cámaras independientes. Cada una va a constituir una celda o vaso.
- Placas: Los elementos básicos de la celda, junto con el separador y el electrolito. Los explicamos en el siguiente apartado.
- Válvula de seguridad: Tanto la sobrecarga como la sobredescarga de la batería puede generar pequeñas cantidades de hidrógeno gaseoso, de manera que se necesita una forma de escape del gas en caso de mal funcionamiento o utilización incorrecta.
Además, en el etiquetado de una batería de 12 voltios siempre vamos a encontrar tres parámetros clave (click aquí si buscas información sobre cómo elegir una batería):
- Tensión: Obviamente, debe de ser 12 voltios. Camiones y embarcaciones suelen utilizar 24 voltios… pero son el doble de largas (porque tienen el doble de celdas) de manera que la confusión es muy difícil.
- Intensidad máxima de descarga: Expresada en amperios (A). Junto con la tensión de la batería, nos indica la potencia máxima que puede proporcionar la batería de manera puntual. Por ejemplo, una batería de 300 A podría entregar puntualmente (durante el arranque, para entendernos) hasta 3.600 vatios de potencia. Es importante, al sustituir la batería, que este parámetro no sea inferior al recomendado por el fabricante.
- Capacidad de la batería: Expresada en Ah o Amperios-hora. Al multiplicar por la tensión, nos hacemos una idea de la cantidad de energía almacenada en la batería. Por ejemplo, una batería de 100 Ah podría entregar 1,2 kWh de energía. Este parámetro puede resultar engañoso, porque la velocidad a la que se entrega esa energía (es decir, la potencia de descarga) afecta a la cantidad de energía que se puede obtener de una batería. En cualquier caso, cuando reemplaces tu batería, deberás decantarte por una que ofrezca una capacidad similar o superior a la recomendada por el fabricante. De lo contrario, el coche arrancará, pero acortarás la vida de la batería.

3) Anatomía típica de una celda
Las celdas de las batería de 12 voltios cuentan con los mismos elementos clave que cualquier otra celda. Tienen un par de colectores para la corriente (uno es el negativo, y el otro, el positivo) y, físicamente en contacto con estos tienen placas. La mitad de ellas están conectadas al polo negativo, donde se «producen» los electrones. Y la otra mitad está conectada al colector positivo, donde se «reciben» los electrones.
A las del polo negativo se las llama ánodo, y las del polo positivo se las llama cátodo. Todas las placas están sumergidas en un líquido llamado electrolito. En el caso de la batería de plomo-acido, se trata de una disolución acuosa de acido sulfúrico. Esta disolución no contiene sales y, en contra de lo que instintivamente puedas creer, no es conductora de la electricidad. Entre placas se coloca un «separador», que es una membrana porosa que impide el contacto físico entre ánodo y cátodo.
Como hemos explicado, la tensión de la celda viene dictada naturalmente por su química. En cuanto a la intensidad máxima (en amperios o A) que puede entregar, está determinada por el número de placas que tenga cada celda y la superficie de estas. La capacidad de la batería (en Amperios-hora o Ah) viene determinada por le número de placas. Como habrás deducido, las baterías más grandes ofrecen más capacidad e intensidad de descarga, y existe cierta relación lineal entre estos dos parámetros.
4) La batería de plomo… ¿es de plomo?
Ahora nos metemos de lleno en la «trastienda» química de la batería y su funcionamiento. Empezando por el nombre, todas las baterías suelen tener uno que identifica la clase de reacción química que tiene lugar en su interior. Nombres hay tantos como químicas. Tenemos las baterías alcalinas, las de mercurio, las de níquel, las de litio… estos nombres son términos técnicos que no describen del todo bien lo que ocurre dentro de la batería, pero nos sirven para entendernos. Y generalmente, hacen referencia al componente principal del ánodo de la batería, que es el elemento que se oxida para generar electricidad.
En el caso de una batería «de plomo», lo primero que tendríamos que subrayar es que el término técnico es «batería de plomo y ácido». Dentro de una de estas baterías, lo que encontramos son unas celdas en las que ocurren dos reacciones químicas. Por un lado, en el ánodo, o polo negativo, el plomo reacciona con ácido sulfúrico y se «oxida». La reacción se escribe como Pb + HSO−4 → PbSO4 + H+ + 2e−. Suena intimidante, pero lo único que nos interesa es ese término «+2e» Eso significa que suelta dos electrones. Al hacerlo, se crea una tensión, que es de 2,05 voltios por celda.
Por su parte, en el cátodo o polo positivo, comienza a querer producirse la siguiente reacción: PbO2 + HSO−4 + 3H+ + 2e− → PbSO4 + 2H2O. De nuevo un galimatías intimidante, pero esencialmente dice que, con dos electrones, el óxido de plomo del cátodo ( PbO2) se convierte en sulfato de plomo ( PbSO4).
En todo este proceso, el papel del ácido sulfúrico es de mero transportador de cargas. El polo negativo «suelta» un protón ( H+), y el positivo lo «recoge» y lo «casa» con un electrón que le llega por un cable. Por el camino, ese electrón ha hecho un trabajo. Por ejemplo, arrancar el coche.
Cuando llega el momento de recargar la batería, basta con proporcionar una corriente inversa a la que se genera naturalmente para que la reacción se invierta. Durante la recarga, el sulfato de plomo del ánodo vuelve a convertirse en plomo… y el sulfato de plomo del cátodo vuelve a convertirse en óxido de plomo.

A lo largo de la historia, la batería de plomo-ácido ha demostrado ser un gran invento. Ha servido para propulsar submarinos… y también para conseguir récords de velocidad como el de La Jamais Contente (arriba), que alcanzó los 100 km/h el 1 de mayo de 1899. No obstante, su característica ganadora es que se trata de una batería recargable que combina bajo coste con una potencia elevada.
Sin embargo, desde el punto de vista de la electro-movilidad, y por desgracia, las baterías de plomo-acido no ofrecen ningún futuro. Sus prestaciones no solo son inferiores a las de sus alternativas de iones de litio, sino que son claramente insuficientes para construir un automóvil eléctrico viable. De hecho, ese ha sido el motivo por el que hemos tardado en tener coches eléctricos.
Una batería de plomo-ácido puede acumular unos 25 Wh por kilo de peso. Eso es entre 4 y diez veces menos que las alternativas basadas en iones de litio. Podrían hacerse coches eléctricos con baterías de plomo… pero estaríamos hablando de baterías que pesarían, como mínimo, entre 2 y 3 toneladas.
Fuente: Autof


















